水素結合部位を導入したポルフィリン錯体の合成と性質
血液中で酸素の運搬を担うヘモグロビン中に存在するヘム鉄、光合成において光を吸収するクロロ
フィルなどは、いずれも活性中心としてポルフィリンを有し、生体内で重要な働きを担っています。
また、ポルフィリンを配位子とした金属錯体は、酸素運搬や酸化反応など非常に優れた機能をもつ
ことが知られています。
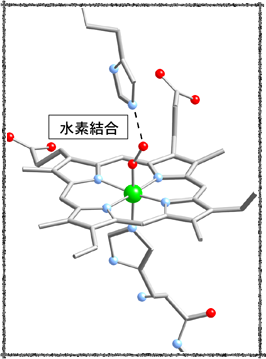
たとえば、鉄に直接配位しているヒスチジン残基(近位ヒスチジン)以外に、鉄に配位している酸素分子との間に水素結合を形成している、ヒスチジン残基(遠位ヒスチジン)の存在が、この酸素の配位を安定化させることが分かっています。
そこで、当研究室では酸素分子の固定・活性化の解明を目指し、遠位ヒスチジンの役割を担う置換基としてアミド基を金属中心の近傍に導入した新規ポルフィリン錯体の合成を行い、酸素分子との反応性を検討しています。
特に、酸素運搬の機能発現についてはこれまでに多くの研究が行われ、これらの機能発現には、
中心金属や配位子の影響の他に、ポルフィリン骨格を取り巻く周囲の環境が非常に重要な役割を
果たしていると考えられています。



ヒスチジン残基によって安定化される酸素分子の鉄ポルフィリンへの配位


・ K. Yamanishi, T. Yairi, K. Suzuki, M. Kondo,* Chem. Commun., 2013, 49, 9296-9298. [DOI: 10.1039/c3cc44558e]
-
 “Biomimic Oactivation hydroxylates a meso-carbon of the porphyrin ring regioselectively under mild conditions”
“Biomimic Oactivation hydroxylates a meso-carbon of the porphyrin ring regioselectively under mild conditions”
~ Recent Papers ~
-
 "Conversion of Co(II) Porphyrin to a Helical Co(III) Complex of Acyclic Pentapyrrole"
"Conversion of Co(II) Porphyrin to a Helical Co(III) Complex of Acyclic Pentapyrrole"
・ K. Yamanishi, M. Miyazawa, T. Yairi, S. Sakai, N. Nishina, Y. Kobori, M. Kondo*, F. Uchida
Angew. Chem. Int. Ed., 2011, 50, 6583-6586. [DOI: 10.1002/anie.201102144]
生体内では様々な反応が行われており、これらの反応は多様な金属酵素によって触媒されています。金属酵素が触媒する生体内での反応は、実験室で行われているフラスコ内での反応と比較して高選択的で高効率である反応例が多く知られています。このような生体内で行われている反応の人工的応用に向けて、生体反応を触媒している金属酵素の構造や反応メカニズムの解明などの研究が盛んに行われています。
そして、金属酵素を対象にした研究方法の1つとして金属酵素の活性中心の構造を模倣したモデル錯体を合成し、この金属錯体を用いて金属酵素の機能を再現する方法が知られています。この研究方法は、低分子である金属錯体を用いることから、高分子である金属酵素と比べて扱いやすい特徴を持っています。このような目的で合成されたモデル化合物によって得られた情報から金属酵素による反応過程が解明されてきました。
当研究室では、ポルフィリン錯体を活性中心に持つ金属酵素の機能解明と触媒化学的応用を目指して研究を進めています。
ポルフィリン錯体
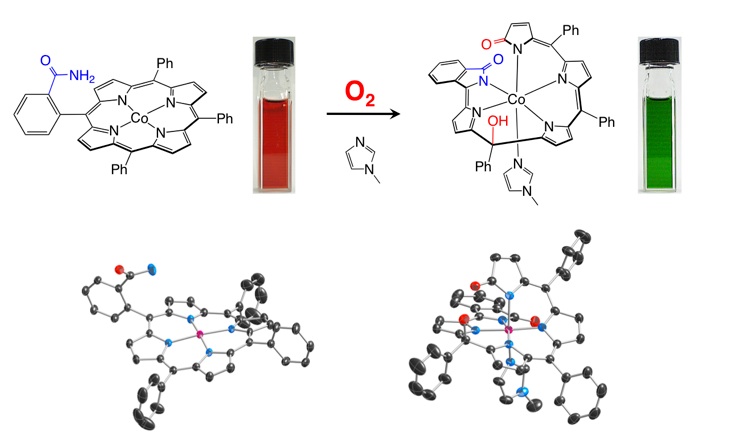
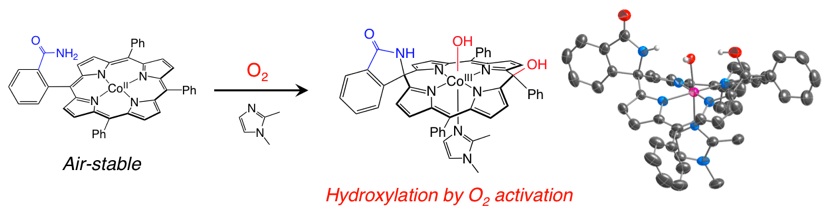
これまでに当研究室では、アミド基を持つコバルトポルフィリン錯体が、そのままでは酸素分子に対して不活性であるにも関わらず、イミダゾールなどの窒素塩基が第5配位座に配位することで特異的な酸素分子との酸化反応が進行し、ポルフィリン骨格が切断された螺旋骨格を持つ錯体やポルフィリン骨格に酸素原子が導入されたポルフォジメテン骨格を持つ錯体へと変換されることを見出しています。
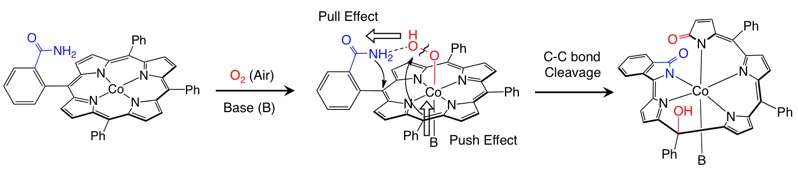
活性化された酸素分子による C=C 結合の切断
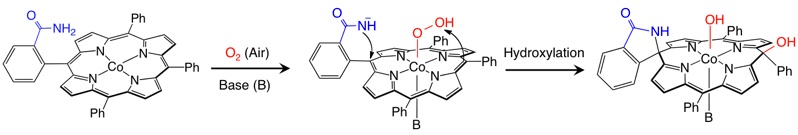
活性化された酸素分子による sp2 炭素の酸化